問題
2種類の金属A,Bを空気中で十分に加熱すると酸素と化合し、それぞれ下のグラフに示すような割合で酸化物ができるのとする。
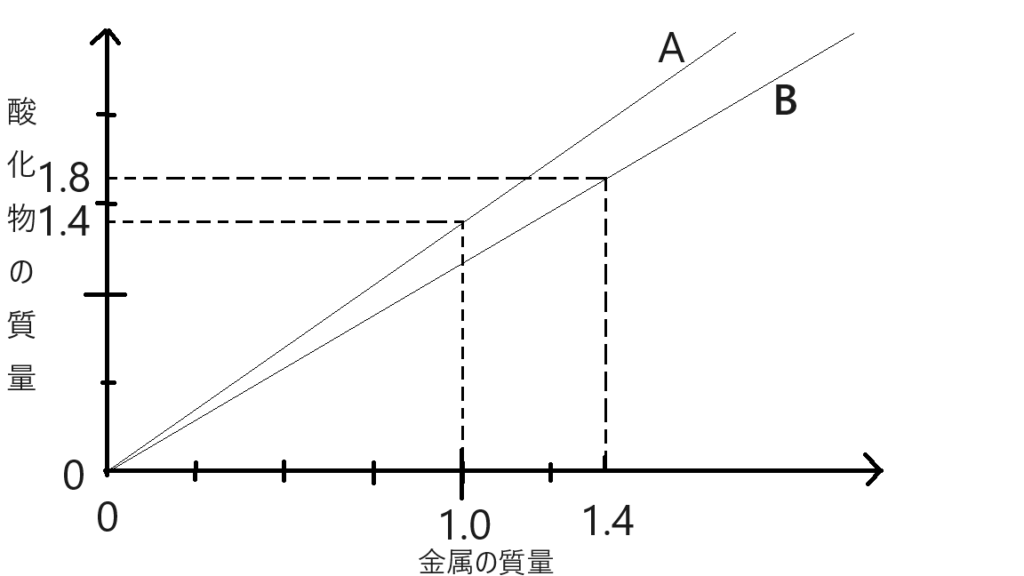
⑴同量の酸素と化合する金属AとBの質量比を最も簡単な整数比で求めなさい。
⑵金属A3.0gを加熱したところ、加熱後の質量が3.8gになった。この時、未反応の金属Aは何gか。
⑶金属AとBの混合物4.4gを十分に加熱したところ6.0gになった。混合物中の金属AとBの質量をそれぞれ求めなさい。
答え
⑴5:7
⑵1.0g
⑶金属A 3.0g, 金属B 1.4g
⑴金属の質量比の求め方
⑴同量の酸素と化合する金属AとBの質量比を最も簡単な整数比で求めなさい。
まず、金属と酸素がどのくらいの質量比で結びついているかを調べます
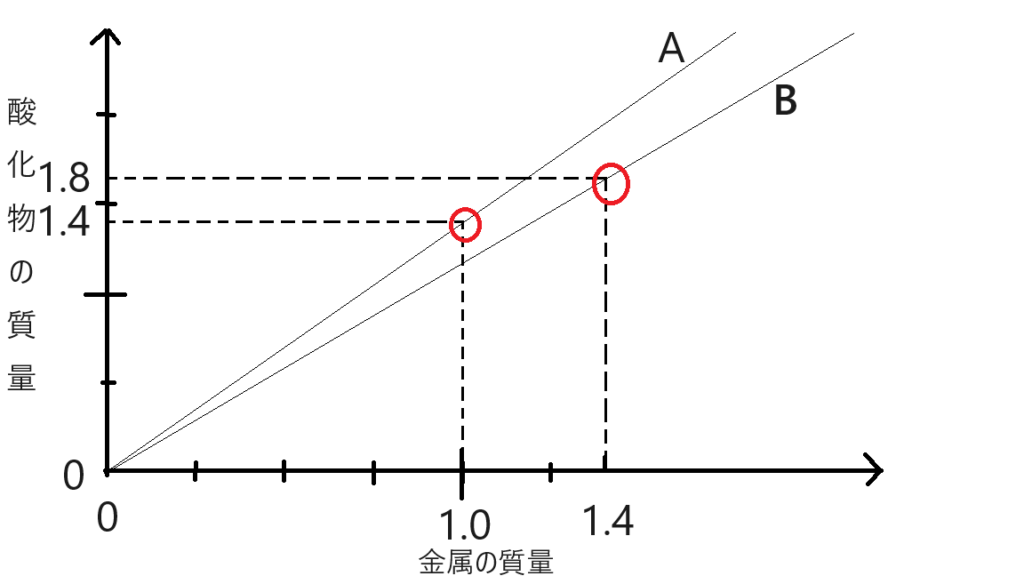
金属Aの場合、酸化物と金属が1.4gと1.0gで結びついているので
酸素:金属A=0.4g:1.0g=2:5
金属Bの場合、酸化物と金属が1.8gと1.4gで結びついているので
酸素:金属B=0.4g:1.4g=2:7
これをくっつけると
金属A:金属B:酸素=5:7:2
よって、同量の酸素と化合する金属AとBの質量比は5:7
⑵未反応の金属の求め方
⑵金属A3.0gを加熱したところ、加熱後の質量が3.8gになった。この時、未反応の金属Aは何gか。
3.0gの金属を加熱して3.8gになるのだから、0.8gは酸素ということになります
ここで⑴で求めた 酸素:金属A=0.4g:1.0g=2:5 を使います
$$酸素が0.8gなので反応した金属は\frac{5}{2}倍した2.0gであることがわかります$$

そして、金属Aの質量から反応した金属Aの質量を引くと反応しなかった金属Aの質量が求まります
3.0-2.0=1.0g
⑶2つの金属の混合物
⑶金属AとBの混合物4.4gを十分に加熱したところ6.0gになった。混合物中の金属AとBの質量をそれぞれ求めなさい。
金属Aと金属Bの質量をxg,ygとすると和は4.4gなので
$$x+y=4.4$$
金属Aと金属Bが酸化した質量は6.0gなので
$$\frac{7}{5}x+\frac{9}{7}y=6$$
(この方程式が最も重要なポイントです)
この二つの方程式を解くと
x=3,y=1.4 となります
よって、金属Aは3.0g、金属Bは1.4gです
コメント